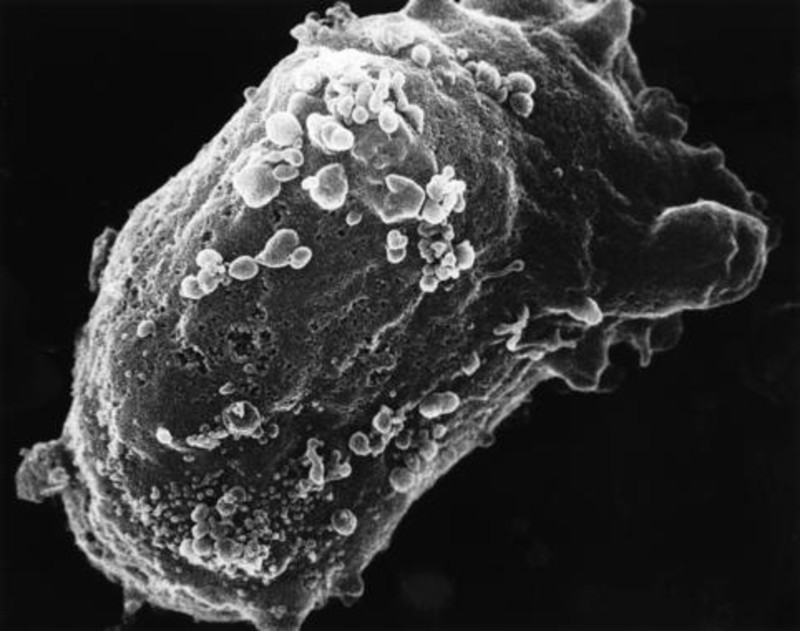
Científicos del Instituto de Investigación del Sida IrsiCaixa, impulsado conjuntamente por la Obra Social “la Caixa” y el departamento de Salud de la Generalitat de Catalunya, han publicado un estudio en la revista Retrovirology en el que demuestran por primera vez que las células mieloides –familia de células del sistema inmunitario– pueden capturar el VIH.
Según los expertos, en lugar de iniciar una respuesta inmunitaria adecuada contra él, estas células lo concentran en gran cantidad y lo transmiten entero a su principal diana, los linfocitos T-CD4. A través de este mecanismo las células mieloides actúan como auténticos ‘caballos de Troya’ y favorecen la rápida expansión del virus por el organismo.
IrsiCaixa ya está investigando un fármaco contra este mecanismo que podría potenciar los tratamientos actuales al bloquear una vía diferente de diseminación del virus. Los tratamientos antirretrovirales existentes dificultan la infección ‘virus a célula’, pero un fármaco en esta línea estaría encaminado a bloquear la transmisión ‘célula a célula’.
Entrada del virus en el sistema inmunitario
En 2012, el mismo grupo descubrió una puerta de entrada del virus del sida al sistema inmunitario. En ese estudio se demostró que el VIH utilizaba la molécula Siglec-1 para penetrar en el interior de unas células mieloides llamadas células dendríticas. Más tarde se demostró que el VIH utilizaba este mismo mecanismo de entrada en otros tipos de células también pertenecientes a la familia de las mieloides: los macrófagos y los monocitos.
No obstante, este mecanismo molecular se había descrito con células mieloides modificadas in vitro, pero se desconocía si Siglec-1 actuaba de la misma forma en células aisladas directamente de tejidos humanos.
Para comprobarlo, los científicos han trabajado ahora con amígdalas de personas no infectadas por el VIH, aislando por primera vez las células mieloides directamente del tejido humano. Los resultados confirman que, también en tejido, estas células tienen la capacidad de actuar como un ‘caballo de Troya’.
En condiciones normales, cuando un patógeno entra en nuestro organismo, las células mieloides ejercen un papel clave en la activación de la respuesta inmunitaria. Su función consiste en patrullar por el organismo, capturar los agentes infecciosos que nos invaden, degradarlos y obtener algunas de sus moléculas.
A continuación, se desplazan a los nódulos linfáticos, que es donde presentan las moléculas del patógeno a los linfocitos T, unas células encargadas de destruir de manera específica los microbios y las células que ya se han infectado.
El problema del VIH es que se aprovecha de las células mieloides y las convierte en dichos invasores refugiándose dentro, en compartimentos, sin llegar a degradarse del todo. Esto le permite llegar entero a sus dianas principales, los linfocitos T-CD4, en vez de iniciar una respuesta inmunitaria adecuada contra el VIH. Así crea un escenario idóneo para la infección de nuevas células y la progresión de la enfermedad.
Papel clave en la diseminación del virus
Además, en el estudio publicado en Retrovirology los investigadores han analizado tejido de un paciente seropositivo y han observado que el receptor Siglec-1 se localiza en dichos tejidos. Esto corrobora ex vivo lo que se había detectado in vitro: que Siglec-1 podría desempeñar un papel clave en la diseminación del virus dentro del organismo.
Por lo tanto, para los expertos, un fármaco que bloquee esta vía de dispersión podría impedir que el VIH use Siglec-1 para introducirse en las células mieloides y que estas a su vez infecten a los linfocitos T-CD4.
También se ha comprobado que, en personas seropositivas, cuanto más Siglec-1 se detecte, más carga viral y menos linfocitos T-CD4 tendrá el paciente. Siglec-1 podría usarse, por tanto, como un nuevo biomarcador del estado de un portador del VIH.
Referencia bibliográfica:
Retrovirology 2015, 12:37 doi:10.1186/s12977-015-0160-x
(IrisCaixa)