SHANGAI, 31 de marzo de 2015 /PRNewswire/
Un equipo de científicos de China y Estados Unidos ha determinado la estructura atómica de un receptor de superficie celular que desempeña un papel vital en la formación de la trombosis. Esta investigación desvela de forma inesperada muchas nuevas características estructurales, que retan los conceptos convencionales de la acción de los fármacos en los receptores acoplados a las proteínas G (GPCRs) y abren una nueva puerta para el descubrimiento de fármacos futuros.
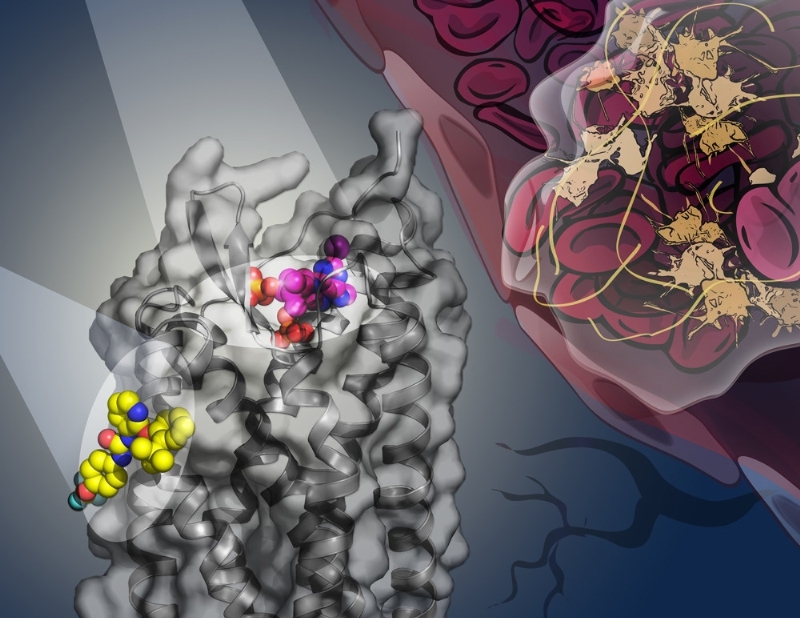
En un documento publicado en Nature el 30 de marzo, los investigadores del Shanghai Institute of Materia Medica (SIMM), Chinese Academy of Sciences, colaborando con los grupos de los National Institutes of Health (NIH, Estados Unidos), Bridge Institute at University of Southern California (Estados Unidos) y el iHuman Institute of ShanghaiTech University (China), proporcionaron un mapa detallado del receptor humano P2Y(1) (P2Y(1)R), un GPCR, dentro de un complejo con antagonista nucleótido MRS2500 y antagonista no nucleótido BPTU.
«Las estructuras P2Y(1)R nos han ayudado a comprender cómo este receptor y los diferentes tipos de fármacos experimentales interactúan a nivel molecular, pudiendo permitir una exploración superior para el diseño de fármacos anti-trombóticos nuevos y seguros con efectos secundarios reducidos», afirmó el líder del equipo, el doctor Beili Wu, profesor del SIMM.
Las estructuras P2Y(1)R revelaron dos sitios completamente distintos vinculantes de lingandos. MRS2500 reconoce un sitio vinculante dentro de la agrupación transmembrana de P2Y(1)R; pese a ello, cuenta con una forma diferente y localización del sitio vinculante nucleótido en la estructura P2Y(12)R que anteriormente estaba determinada por la misma colaboración. «Este descubrimiento destaca la diversidad de los mecanismos de reconocimiento de señal en GPCRs, y es de un gran valor para el diseño de fármacos para cada receptor con una elevada selectividad», comentó el doctor Wu.
El descubrimiento más sorprendente es que BPTU se enlaza con un bolsillo en la intercara exterior del receptor que está integrada dentro de la membrana celular. Se trata del primer ligando GPCR de elevada afinidad y selectivo caracterizado estructuralmente situada enteramente en el exterior de la agrupación helicoidal. Esto abre nuevas oportunidades para ampliar el espectro del descubrimiento de fármacos futuros GPCR para los sitios nuevos destinados fuera del bolsillo convencional vinculante al ligando GPCR, que podría facilitar el desarrollo de nuevos productos farmacéuticos para el tratamiento de numerosas enfermedades.
«Las nuevas estructuras permitirán a los diseñadores de fármacos trabajar de forma más eficaz y con una precisión superior para construir nuevas moléculas y modular la función de este receptor y de otros receptores cercanos relacionados, muchos de ellos con potencial para tratar el cáncer y la inflamación», explicó el coautor y doctor Kenneth Jacobson, investigador senior de los NIH.