Cuando a los fullerenos, una de las formas moleculares del carbono en la naturaleza, se les dota en el laboratorio de carga eléctrica (por ejemplo incluyendo otras moléculas en su interior) pueden resultar muy útiles para la ciencia. Los fullerenos cargados ya se utilizan en biomedicina, sirviendo como agentes de contraste en las resonancias magnéticas y en las imágenes de rayos X, como radiotrazadores e incluso como drogas antimicrobianas y antitumorales.
La dificultad radica en predecir cuál de las múltiples estructuras que pueden adoptar los fullerenos cargados es la que realmente se produce en el laboratorio. Pero en el último número de la revista Nature Chemistry, un equipo de la Universidad Autónoma de Madrid (UAM) y el Instituto IMDEA Nanociencia presenta un algoritmo matemático que permite saber con antelación, en tan solo unas horas y utilizando un simple ordenador de mesa, la estabilidad relativa de todos los isómeros de un fullereno cargado.
Los fullerenos cargados sirven de agentes de contraste en resonancias magnéticas e imágenes de rayos X
El algoritmo se basa exclusivamente en la topología del sistema, es decir, en la forma en la que están interconectados los átomos de carbono que constituyen el fullereno, evitando por tanto resolver las complicadas ecuaciones de la física cuántica.
“Utilizando este sencillo algoritmo matemático hemos conseguido encontrar, de entre millones de estructuras posibles, las más estables para todos los fullerenos que contienen entre 28 y 104 átomos de carbono, con cargas comprendidas entre -6 y +6. Esto ha permitido justificar el origen de la mayor parte de las estructuras observadas experimentalmente hasta la fecha y predecir la existencia de otras muchas que aún no han sido descubiertas,” explican los miembros del equipo, conformado por Yang Wang, Sergio Díaz-Tendero, Manuel Alcamí y Fernando Martín.
“Estos resultados permitirán sintetizar nuevas especies de fullerenos en el laboratorio, así como desarrollar modelos topológicos similares aplicables a diversos derivados de los fullerenos. Por ejemplo los fullerenos exoédricos, en los que distintas especies atómicas o moleculares se enlazan al fullereno por su parte externa”, detalla Fernando Martín, investigador teórico del departamento de Química de la UAM.
Estructuras tridimensionales cerradas y huecas
Aunque menos conocidos que el grafeno y menos abundantes que otros compuestos de carbono como el grafito o el diamante, el descubrimiento de los fullerenos en 1985 mereció (11 años después) el premio Nobel de Química, y dio un impulso definitivo a lo que hoy se conoce como nanotecnología, una de las disciplinas científicas más activas en las últimas décadas.
La forma más estable es el fullereno C60, similar a un balón de fútbol
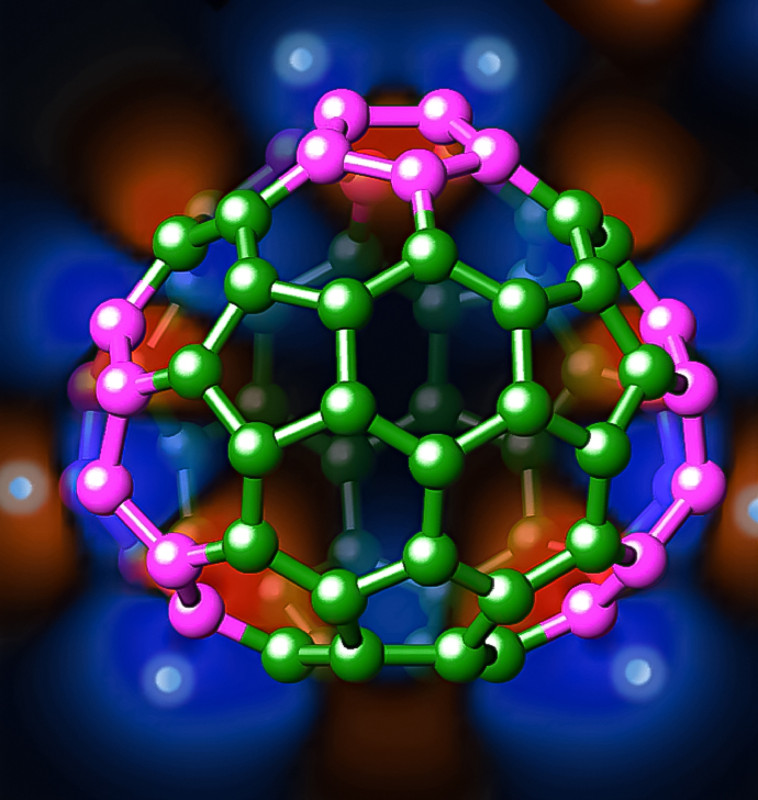
A diferencia de las otras formas moleculares del carbono, los fullerenos adoptan estructuras tridimensionales cerradas y huecas, generalmente esféricas, constituidas por decenas (o a lo sumo unos pocos centenares) de átomos de carbono. Son por tanto estructuras que miden tan solo unos cuantos nanómetros.
Dado un número de átomos de carbono, existen muchas maneras de distribuirlos en el espacio formando una de estas estructuras huecas. La más conocida contiene 60 átomos de carbono y es la forma más estable del fullereno, el denominado ‘buckminsterfullereno’ o ‘fullereno C60’, que es similar a un balón de fútbol en el que los átomos de carbono ocuparían los vértices de los anillos hexagonales y pentagonales.
Pero esta no es la única forma en la que se pueden colocar 60 átomos de carbono para formar una estructura cerrada y hueca. Un sencillo cálculo matemático muestra que hay 1.812 formas distintas de construir un fullereno con 60 átomos de carbono. A cada una de estas formas se le denomina un isómero, y cada una tiene propiedades distintas. El número de isómeros crece exponencialmente cuando se consideran fullerenos con un número mayor de átomos de carbono. En el caso del C104, por ejemplo, el número de isómeros posibles es tan grande como 419.013.
Predecir la estructura más estable
Predecir cuál de estas estructuras es la más estable, es decir, cuál es la que realmente se puede observar en la naturaleza, conlleva en principio la resolución de las ecuaciones de la física cuántica para cada uno de los posibles isómeros. La tarea resulta imposible para un número de isómeros tan grande como el de los ejemplos anteriores.
La situación se complica aún más cuando se consideran fullerenos cargados eléctricamente, es decir, fullerenos que han ganado o perdido uno o varios electrones, lo cual sucede muy a menudo cuando se sintetizan junto con otras especies atómicas o moleculares. Este es el caso de los fullerenos endoédricos, donde esas otras especies se sitúan en el interior hueco del fullereno. O el caso de los fullerenos que se encuentran en el espacio interestelar, o que se generan al ser bombardeados por iones, electrones o fotones.
Efectivamente, estudios experimentales recientes han puesto de manifiesto que los isómeros más estables en estos casos no son necesariamente los mismos que en fullerenos neutros. Más aún, la estabilidad relativa de los distintos isómeros varía con la carga. Ello hace que, para cada valor de la carga, se deban considerar un número igualmente gigantesco de isómeros posibles para predecir cuál de ellos es el más estable. Esta dificultad queda en gran parte resuelta gracias al desarrollo del nuevo algoritmo propuesto por el grupo de investigadores.
_____________________
Referencia bibliográfica:
“Cage connectivity and frontier π orbitals govern the relative stability of charged fullerene isomers”, Nature Chemistry, DOI: 10.1038/nchem.2363.