Las células tumorales utilizan la glucosa como fuente de energía para crecer y desarrollarse. Un estudio con participación del Consejo Superior de Investigaciones Científicas (CSIC) ha demostrado que el bloqueo de la glicólisis –mecanismo molecular que permite extraer la energía de la glucosa– influye en la división de las células tumorales. El trabajo, que se publica en la revista Nature Cell Biology, indica que este bloqueo podría ser efectivo para el tratamiento del cáncer en combinación con agentes quimioterapéuticos como el taxol.
Una de las características de las células cancerígenas es su capacidad para dividirse de manera incontrolada y casi ilimitada. Por eso, los científicos se plantearon en este estudio, dirigido por el investigador del Centro Nacional de Investigaciones Oncológicas Marcos Malumbres, la forma en que las células tumorales consiguen la energía para mantener su alto ritmo de división.
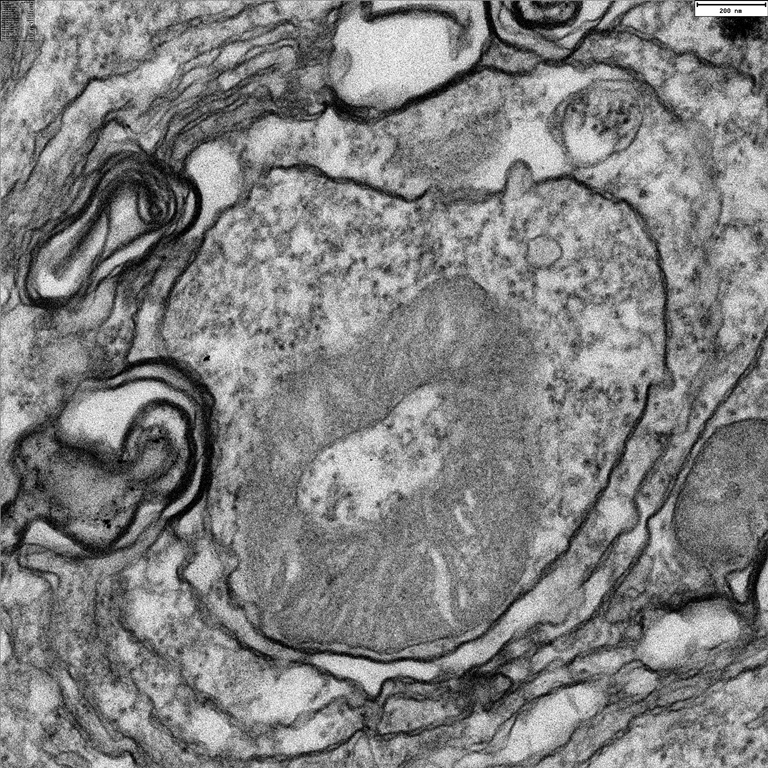
El CSIC ha colaborado mediante el estudio del metabolismo energético y la demostración de la importancia de la mitofagia, proceso celular que se encarga de la degradación y del reciclaje selectivo de las mitocondrias, en la supervivencia de las células cuando estas están detenidas en mitosis, es decir, el proceso de división celular en el que se reparte el material genético de la célula madre a las hijas.
La muerte de la célula tumoral por inanición
Para frenar la división de las células cancerígenas, una de las estrategias empleadas es la detención de la mitosis. Durante la mitosis, muchos procesos celulares están detenidos y, sin embargo, se produce un importante gasto energético. “Cuando se para la mitosis hay una pérdida rápida en la producción mitocondrial de energía. Y para superar esta situación de estrés, la célula pone en marcha estrategias para su supervivencia”, apuntan los investigadores del CSIC Patricia Boya y Eduardo Rial, del Centro de Investigaciones Biológicas.
Con los tratamientos de quimioterapia que detienen la mitosis, como ocurre con el taxol, las células tumorales incrementan las necesidades de glucosa. El estudio señala que si se bloquea la glicólisis se potenciaría el efecto anticancerígeno de los fármacos, ya que las células cancerígenas morirían de inanición al no poder obtener energía para realizar sus funciones vitales.
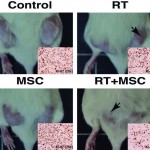
Tomando como modelos células de cáncer de mama y ratones, los autores de trabajo han demostrado que si se utiliza una terapia combinada en la que se detenga la mitosis en las células y se ataquen los procesos que permiten su supervivencia, se aumentará notablemente la eficacia del tratamiento.
Junto al CSIC, en el estudio han participado el Centro Nacional de Investigaciones Oncológicas, el Instituto de Investigación Biomédica Barcelona, la Universidad Complutense de Madrid, la Universidad de Santiago de Compostela y la Universidad de Boston (EE. UU.).
| Referencia bibliográfica | |
|
E. Doménech, C. Maestre, L. Esteban-Martínez, D. Partida, R. Pascual, G. Fernández-Miranda, E. Seco, R. Campos-Olivas, M. Pérez, D. Megias, K. Allen, M. López, A. K. Saha, G. Velasco, E. Rial, R. Méndez, P. Boya, M. Salazar-Roa y M. Malumbres. AMPK and PFKFB3 mediate glycolysis and survival in response to mitophagy during mitotic arrest. Nature Cell Biology. DOI: 10.1038/ncb3231 |
(CSIC/DICYT)