La autofagia, del griego “autoalimentación”, es un proceso fundamental para degradar y reciclar componentes celulares. El doctor Yoshinori Ohsumi, del Instituto Tecnológico de Tokio, fue laureado con el Premio Nobel de Medicina 2016 por descubrir en la levadura que se usa para hacer pan, cuáles son los genes que dan las instrucciones para realizar este mecanismo.
En la autofagia, una célula destruye sus propios contenidos encerrándolos en unas membranas, formando vesículas (autofagosomas) en forma de saco para luego transportarlos a un compartimiento de reciclaje, llamado vacuola (tiene la misma función que los lisosomas en mamíferos), para la degradación total. Este proceso se conoce desde hace más de medio siglo, su importancia fue reconocida en 1974, cuando el Instituto Karolisnka, que dictamina el Premio Nobel, le otorgó el galardón de Fisiología y Medicina a Christian de Duve, por haber descubierto los lisosomas y acuñar el concepto autofagia.
“Si no se hubiera descrito en la levadura (organismos eucariotas) cuáles son los genes que llevan a cabo la autofagia, no hubiera sido posible entender este mismo mecanismo en los mamíferos. Los genes de la autofagia son muy parecidos en los organismos eucariontes. Por eso es tan importante el trabajo del laboratorio del doctor Ohsumi”, dijo la investigadora Susana Castro Obregón, del Instituto de Fisiología Celular de la UNAM, quien estudia el papel que desempeña la autofagia en el desarrollo y envejecimiento del sistema nervioso.
El doctor Noboru Mizushima, de la Universidad de Tokio, quien realizó su trabajo posdoctoral con el doctor Ohsumi, encontró que la batería genética que ejecuta la autofagia descubierta por Yoshinori también está presente en los mamíferos, pero lo más interesante del trabajo de Mizushima es que diseñó un ratón transgénico (GFP-LC3) en el que fusionó una proteína de fluorescente en verde, llamada proteína verde fluorescente, a uno de los genes necesarios para llevar a cabo la autofagia, denominados genes ATG (autofagia), que le permitió demostrar que en el ratón también existen las mismas vesículas para llevar a cabo la autofagia de la misma manera en que ocurre en la levadura, expuso Castro en entrevista para la Academia Mexicana de Ciencias.
“Gracias al diseño de este ratón se puede detectar cuándo se está llevando a cabo la autofagia porque sigue la fluorescencia en verde de esta proteína”. Mizushima comparte con cualquier investigador de cualquier parte del mundo el ratón de su creación, lo que ha permitido estudiar el proceso en los mamíferos, tanto en su relevancia en la vida normal, como en la fisiología, en el desarrollo embrionario o en el adulto, así como en las enfermedades cuando no funciona bien la autofagia”, apuntó. En México hay varios investigadores que utilizan este ratón, como el grupo de la doctora Sandra Cabrera, de la Facultad de Ciencias de la UNAM y en el de la doctora Castro Obregón.
Este ratón podría verse como una relación indirecta de los investigadores mexicanos que usan el ratón GFP-LC3 con el Premio Nobel, pues Ohsumi fue el maestro de Misuzhima.
Activar e inhibir la autofagia
Susana Castro mencionó que cuando la autofagia no funciona el cerebro no se forma correctamente en el desarrollo embrionario, por lo que su equipo trata de responder por qué ocurre esto.
Cuando se inicia la formación del cerebro, se forma primero el tubo neural. Si este no se forma correctamente se originan distintas malformaciones con diferentes niveles de gravedad, conocidas como “defectos del tubo neural”. La espina bífida es uno de eso defectos. “Si es muy grave la lesión el producto no nacerá. Pero en los humanos la espina bífida es una malformación frecuente. Uno en cada diez mil embarazos tiene defectos del tubo neural, pensamos que si podemos prevenir estos defectos podríamos evitar que naciera gente con espina bífida y/o defectos del tubo neural”.
El tipo de experimentos que lleva a cabo el grupo de la doctora Castro para estudiar el desarrollo embrionario es utilizando una incubadora en la que colocan a embriones de ratón justo en la edad en la que se está formando el tubo neural para que ahí continúe su desarrollo y puedan inhibir o activar la autofagia. “Si inhibimos la autofagia no se forma el tubo neural. Ahora lo que estamos estudiando es qué genes son los que se necesitan o cuáles son las moléculas que están participando que permitan se cierre bien el tubo neural”.
En cuanto al envejecimiento, Susana Castro y su equipo descubrieron que cuando las neuronas senescen es porque la autofagia ya no funciona por completo: las vesículas (autofagosomas) que descubrió Yoshinari Ohsumi sí reconocen el material (mitocondrias dañadas, entre otros) que van a degradar, lo engullen, pero ya no lo llevan al lisosoma (vacuola, en el caso de la levadura) y no se degrada.
“Si pudiéramos descubrir por qué se detiene el mecanismo podríamos evitar que pare y creemos que esta es la causa de las neurodegeneraciones, cuando no funciona bien la autofagia se favorece enfermedades como Alzhaimer, Parkinson, o enfermedades metabólicas como diabetes, cáncer. Creemos que muchas de las manifestaciones que aquejan al organismo anciano se podrían prevenir si se mantiene la autofagia funcionando bien a lo largo de la vida”.
Para estudiar el envejecimiento, la fisióloga celular comentó que en su laboratorio llevan a cabo estudios en dos líneas. Por un lado, colocan en una caja de cultivo neuronas de una rata un día antes de que nazca, lo que les permite manipular la autofagia, activarla (dándole un tipo de azúcar) o inhibirla (con un compuesto que degrada los productos de algunos genes de la autofagia). Cada vez que descubren que pasó en las células en cultivo proceden a estudiar si en el cerebro de un animal (rata) viejo, de 25 meses, también ocurre.
“Poder reproducir en cultivo el proceso de envejecimiento de las neuronas es muy bueno porque vamos a poder entender más rápido el mecanismo molecular, y lo que ya estamos probando es que podemos activar la autofagia en el ratón viejo. Pensamos que vamos a poder hacer que las neuronas que ya estaban viejitas rejuvenezcan, hasta ahora no lo hemos podido demostrar, pero trabajamos en ello”.
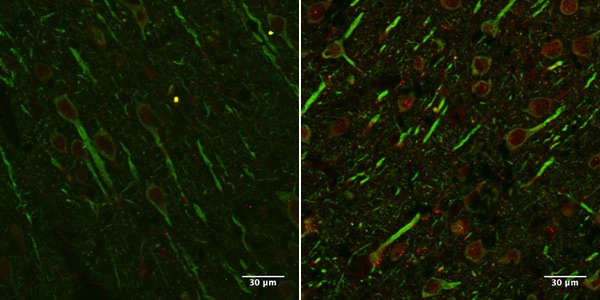
Imagen de corte de cerebro de rata GFP-LC3. Izquierda: rata de 4 meses, en verde se ve una proteína que solo producen las neuronas; en rojo se ve una proteína que producen las células senescentes. Derecha: rata de 25 meses, en las neuronas de animales de esta edad el rojo es más intenso, lo que indica que producen más de esa proteína.