Un equipo de investigadores de la Universidad Autónoma de Madrid (UAM) ha puesto de manifiesto una debilidad del melanoma: su dependencia de la proteína LOXL3, abriendo así nuevas perspectivas para el tratamiento de este tipo de cáncer.
El trabajo, publicado en la revista Cell Death & Differentiation, demuestra que las células de melanoma utilizan LOXL3 (Lysyl Oxidase-Like 3) para crecer y saltarse los controles responsables de evitar el desarrollo del cáncer.
“Curiosamente, las células de la piel donde se origina el melanoma, los melanocitos, no expresan LOXL3, y no necesitan esta proteína para vivir. En cambio, si los melanocitos sufren mutaciones que les permiten crecer de forma descontrolada, la presencia de LOXL3 favorece que continúen creciendo y puedan convertirse en melanomas capaces de invadir tejidos cercanos y diseminarse por el cuerpo”, explican los autores.
La eliminación de LOXL3 en células tumorales antes de que el melanoma se convierta en un tumor agresivo podría frenar su crecimiento e incluso provocar su desaparición
“Al impedir que LOXL3 se exprese en las células derivadas de tumores de melanoma –detallan–, estas dejan de crecer y acaban muriendo por apoptosis o muerte celular programada. La eliminación de LOXL3 en células tumorales antes de que el melanoma se convierta en un tumor agresivo podría frenar su crecimiento e incluso provocar su desaparición”.
El equipo se centra ahora en el desarrollo de fármacos capaces de eliminar LOXL3 en lesiones premalignas, como son determinados tipos de lunares. “Estos deberán ser antes ensayados en modelos animales para determinar su eficacia”, apunta Patricia G. Santamaría, coautora del estudio.
Eliminación de LOXL3 y apoptosis
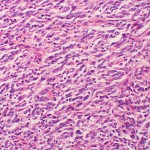
Las células tumorales se caracterizan por crecer rápida y desorganizadamente, lo que hace que acumulen mutaciones. En una célula normal no tumoral existen sistemas de control que sirven para detectar anomalías y promover que la célula deje de crecer e incluso muera por apoptosis si acumula muchos fallos genéticos. En ocasiones, esas mismas alteraciones pueden favorecer que una célula normal se convierta en una célula tumoral y ya no sea capaz de activar o responder a los sistemas internos de control.
Esa célula descontrolada puede crecer indefinidamente, formar tumores primarios, trasladarse a órganos vitales y formar tumores secundarios o metástasis, impidiendo su correcto funcionamiento y provocando en ocasiones la muerte.
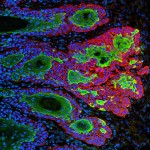
En el caso del melanoma, LOXL3 contribuye a que la célula tumoral viva cómodamente en presencia de numerosas anomalías como daños en su material genético, característicos de este tipo de cáncer.
“Es decir, LOXL3 confiere ventajas a las células de melanoma que, cuando tienen LOXL3, no mueren entre otros motivos porque sus sistemas internos de control no funcionan adecuadamente”, explica Amparo Cano, de la UAM.
El equipo se centra ahora en el desarrollo de fármacos capaces de eliminar LOXL3 en lesiones premalignas, como son determinados tipos de lunares
“Sin embargo –agrega la investigadora– si se elimina LOXL3 mediante una técnica denominada silenciamiento génico, o mediante la tecnología CRISPR/Cas9, esas mismas células tumorales no soportan los daños acumulados, dejan de crecer y acaban muriendo por apoptosis”.
Mecanismos epigenéticos
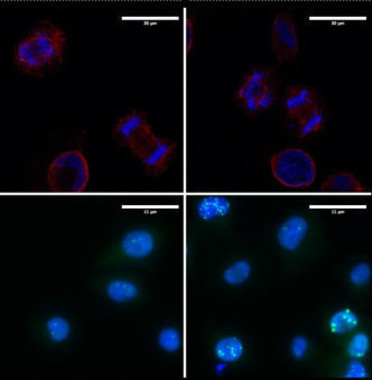
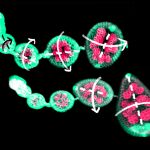
Los científicos han descubierto que LOXL3 es indispensable para la supervivencia de las células de melanoma. Sin LOXL3, las células tumorales no pueden dividirse de forma correcta y el ADN no se reparte equitativamente a las células ‘hijas’ que van acumulando alteraciones en su genoma.
Cuando las células detectan los errores saltan las alarmas, pero no son capaces de activar los sistemas de control que permiten a las células reparar el daño en el ADN. La acumulación de anomalías que esto provoca hace que las células no puedan sobrevivir.
La causa por la que los melanocitos no expresan LOXL3 y sin embargo las células tumorales sí, recae en mecanismos epigenéticos, que permiten alterar la actividad del ADN sin modificar su secuencia. Las regiones del genoma que regulan la expresión del gen de LOXL3 presentan una señal genética o metilación en células no tumorales y, por motivos que todavía no se conocen, esa metilación desaparece en los tumores.
Estos resultados han sido obtenidos por investigadores del grupo de Amparo Cano de la UAM y el Instituto de Investigaciones Biomédicas Alberto Sols (centro mixto UAM-CSIC), perteneciente a CIBERONC e IdiPAZ, en colaboración con el grupo de la Dra. Eva Hernando de NYU, y con la participación de investigadores de IDIBELL y CNIO.
Referencia bibliográfica:
Patricia G. Santamaría, Alfredo Floristán, Bárbara Fontanals-Cirera, Alberto Vázquez-Naharro, Vanesa Santos, Saleta Morales, Lourdes Yuste, Héctor Peinado, Antonio García-Gómez, Francisco Portillo, Eva Hernando & Amparo Cano. «Lysyl oxidase-like 3 is required for melanoma cell survival by maintaining genomic stability«. Cell Death & Differentiation DOI: 10.1038/s41418-017-0030-2.