El Grupo de Telómeros y Telomerasa del Centro Nacional de Investigaciones Oncológicas (CNIO), en colaboración con la Unidad de Ratones Transgénicos del mismo centro, ha logrado crear en el laboratorio ratones con telómeros hiperlargos y con un menor envejecimiento molecular, evitando el uso de la que hasta ahora era la vía habitual: la introducción de genes.
Esta nueva técnica, basada en cambios epigenéticos y descrita hoy en Nature Communications, evita la manipulación de genes para retrasar el envejecimiento molecular. El estudio también subraya la importancia de esta nueva estrategia para generar células madre embrionarias y células iPS con telómeros muy largos para su uso en medicina regenerativa.
Los telómeros (estructuras protectoras situadas en los extremos de los cromosomas) son esenciales para la estabilidad del material genético y para mantener el estado juvenil de las células y el organismo.
Los telómeros son esenciales para la estabilidad del material genético y para mantener el estado juvenil de las células y el organismo
Sin embargo, los telómeros se van acortando a medida que envejecemos. Llegado un punto crítico de acortamiento, las células entran en senescencia o mueren. Esta es una de las causas moleculares del envejecimiento celular y de la aparición de enfermedades asociadas a la vejez.
Por el contrario, cuando los telómeros tienen una longitud extra –cosa que logró por primera vez el grupo del CNIO dirigido por Maria A. Blasco usando la expresión del gen de la telomerasa– ejercen un papel protector frente al envejecimiento y las enfermedades asociadas a él, prolongando significativamente la vida de los ratones.
Cómo alargar los telómeros
Tenemos que remontarnos al año 2009, cuando en un trabajo publicado en la revista Cell Stem Cell se describía que el cultivo in vitro de células iPS causaba el alargamiento progresivo de los telómeros hasta generar lo que las autoras llamaron ‘telómeros hiperlargos’.
Poco después, en 2011, Elisa Varela (también firmante de este último paper) y sus colegas del CNIO publicaron en la revista Proceedings of the National Academy of Sciences (PNAS) que este fenómeno también ocurría de forma espontánea en las células madre embrionarias cuando se cultivaban in vitro.
“La expansión in vitro de las células madre embrionarias resulta en el alargamiento de los telómeros hasta el doble de la longitud normal en las células del embrión”, explican las autoras. Una elongación que ocurre gracias a mecanismos activos naturales y sin que se produzcan alteraciones en el gen de la telomerasa.
Pero, ¿serían estas células capaces de dar lugar a un ratón con telómeros mucho más largos de lo normal y que envejeciera más lentamente? En el trabajo que se publica hoy en Nature Communications, Elisa Varela y sus colegas demuestran que sí.
Menos daños en el ADN y menos tumores
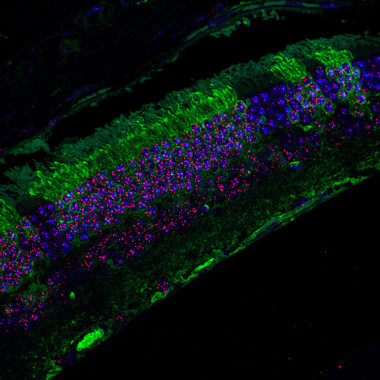
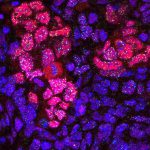
Las células con telómeros hiperlargos de estos ratones parecen ser perfectamente funcionales. Al analizar los tejidos en diferentes momentos (0, 1, 6 y 12 meses de vida), estas células mantenían el gradiente extra de longitud (decrecían con el tiempo pero a un ritmo normal), presentaban menor acumulación de daños en el ADN y tenían mayor capacidad para la reparación de heridas en la piel. Además, los animales tenían una menor incidencia de aparición de tumores –tanto esporádicos como inducidos–que los ratones normales.
Las células con telómeros hiperlargos de estos ratones parecen ser perfectamente funcionales
Estos resultados demuestran que las células madre pluripotentes portadoras de telómeros hiperlargos pueden dar lugar a organismos con telómeros más largos que se mantienen juveniles a nivel molecular durante más tiempo.
Según las autoras, se trata de “una prueba de concepto de que es posible generar tejidos adultos con telómeros más largos de lo normal en ausencia de modificaciones genéticas”.
“Nuestro trabajo también demuestra que es posible generar iPS con telómeros más largos –explica Blasco– que resultarían en células diferenciadas con telómeros a su vez más largos y que estarían, por tanto, más protegidas del daño”.
Esto podría ser una ventaja en el campo de la medicina regenerativa, donde se está estudiando cómo usar células iPS para generar tipos celulares adultos para terapias celulares. El siguiente paso será “generar una nueva especie de ratón que tenga los telómeros de todas sus células el doble de largos de lo normal”, explican Blasco y Varela.
“De este modo, podremos analizar algunas de las grandes preguntas que aún están sin contestar: ¿Viviría más una especie de ratón que tuviera los telómeros el doble de largos? ¿Es este el mecanismo que ha usado la naturaleza para determinar longevidades muy diferentes en especies genéticamente muy similares? ¿Tendría esta nueva especie más o menos cáncer?
Referencia bibliográfica:
Nature Communications.
Este estudio ha sido financiado por el Ministerio de Economía y Competitividad español, el Consejo Europeo de Investigación (ERC, por sus siglas en inglés), la Comunidad de Madrid, la AXA Research Fund y al Fundación Botín y el Banco Santander a través de Santander Universidades.