Antes de 2012, modificar una parte del genoma era tremendamente complejo, caro y solo servía para unas pocas regiones. Ahora, con la técnica de edición genética CRISPR, se puede hacer en prácticamente cualquier zona de forma rápida, también en células embrionarias. Esta herramienta permite sustituir las partes dañadas del ADN (que puedan dar lugar a enfermedades hereditarias) por otras sanas.
Así, analizando las células del embrión antes de su transferencia al útero materno, es posible detectar e incluso corregir estas alteraciones, aumentando las probabilidades de embarazo de un bebé sano. Con ello, se conseguiría reparar posibles alteraciones genéticas en todas las células futuras del individuo y sus descendientes, así como eliminar la enfermedad asociada. Pero, aunque se trate de un logro con enormes posibilidades, primero será necesario solucionar el debate ético que suscita y los problemas de seguridad de esta técnica.

Dagan Wells durante la rueda de prensa del congreso. / IVI
Durante el 8º Congreso Internacional sobre Medicina Reproductiva del Instituto Valenciano de Infertilidad (IVIRMA), celebrado estos días en Mallorca, Dagan Wells, experto en diagnóstico preimplantacional de la Universidad de Oxford, ha hablado de lo que se ha logrado hasta ahora y las promesas de CRISPR.
“Si un logro científico se aplica mal, corremos el riesgo de retroceder en ese campo de investigación”, ha explicado Wells
“Este tipo de avances generan una gran controversia social, como vimos recientemente con la noticia del nacimiento de dos bebés chinas cuyo ADN había sido modificado”, ha contextualizado Wells, director del centro de investigación básica de IVIRMA Innovation en Oxford.
Precisamente, en marzo de este año, pioneros de CRISPR y expertos en ética de siete países han pedido una moratoria de cinco años para frenar la creación de más bebés genéticamente modificados. Este parón no afecta a la edición de embriones humanos para la investigación ni a la de células somáticas para tratar enfermedades.
“Si un logro científico se aplica mal, corremos el riesgo de retroceder en ese campo de investigación, incluso durante años”, ha explicado Wells.
Para Javier Marqueta, presidente del congreso y director de IVI Mallorca, “en su filosofía la edición genética es maravillosa, ya que con un buen uso se podrían eliminar enfermedades genéticas. El problema surge cuando se abre la puerta a otras modificaciones no dirigidas a curar, sino a la mejora. La técnica no debe usarse saltándose barreras científicas, éticas y legales”.
“Es un área prometedora con un enorme potencial, pero todavía mucha gente de la comunidad cree que no está lista para sus aplicaciones clínicas”, ha continuado Marqueta. “Es un campo en evolución. Lo que sabemos hasta ahora es que puedes corregir estos trastornos hereditarios que han estado en las familias durante generaciones y eliminarlos no solo en ese individuo, sino en su descendencia”.
Qué podría aportar CRISPR a la reproducción asistida
De momento, lo que está legalmente permitido en familias con un alto riesgo de tener un hijo con una enfermedad genética grave (distrofia muscular, talasemia, fibrosis quística) es realizar ciclos de fecundación in vitro (FIV).
En estos tratamientos se pueden producir varios embriones y probar si uno de ellos ha heredado ese defecto que se quería evitar. Pero aún en el caso de que uno de ellos esté libre de mutaciones, el porcentaje de éxito solo llega al 65 % (sin diagnóstico genético preimplantacional es de apenas un 20 %).
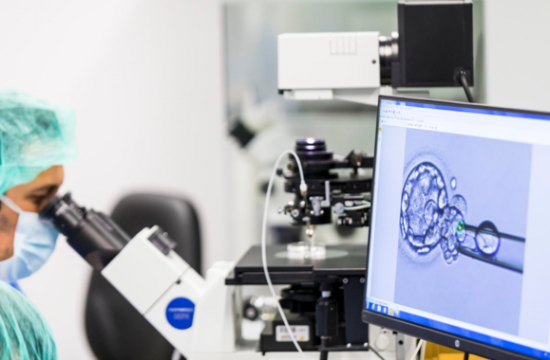
La fecundación de óvulos puede llevarse a cabo mediante FIV convencional o inyección intracitoplasmática de espermatozoides. / IVI
El experto británico explica que, como con este método se crean embriones y luego se descartan, para algunas personas esto supone un problema ético o religioso. “Con la edición genómica puedes corregir un gen defectuoso en un embrión, por lo que no tendrás que descartar ninguno”.
“Es una técnica que puede mejorar la situación de los pacientes y, por tanto, lo que hay que hacer es regularla”, ha concretado Javier Marqueta
Para algunas personas esto podría ser preferible, aunque tampoco faltan argumentos en contra. “Cualquier cambio que hagamos en estos embriones se pasarán de generación en generación. Se necesita un debate público al respecto. Hay que precisar cuáles serán los beneficios y los desafíos técnicos para establecer un consenso”, ha subrayado Wells.
¿Cómo será el futuro?
“Es una técnica que puede mejorar la situación de los enfermos o de los pacientes de riesgo y, por tanto, lo que hay que hacer es regularla, no se podrá prohibir nunca su uso”, ha concretado Javier Marqueta.
Por el momento, la única licencia de edición genética la tiene desde hace un año y medio Kathy Niakan, del Instituto Francis Crick de Reino Unido. La investigadora cuenta con la aprobación de modificar un solo gen (gen Oct4) en embriones y observar el impacto en su desarrollo. Es el primer paso de un largo viaje para entender cómo funcionan estos genes en el embrión.
“Es altamente probable que en el futuro esta técnica podrá ayudar a muchas familias que sufren por estas condiciones genéticas. Por supuesto, no será algo destinado a toda la población, sino focalizado a esas familias afectadas”, ha concluido Wells.
IVI celebra entre el 4 y el 6 de abril en Mallorca el 8th International IVIRMA Congress sobre Reproducción Asistida, un congreso bienal en el que se han dado cita más de 1600 asistentes de 71 países.