En 1890, William Coley, un cirujano del Hospital de Cáncer de Nueva York, ahora llamado Memorial Sloan Kettering, recibió la visita de una paciente de 17 años llamada Elizabeth Dashiell. Llevaba días con una mano hinchada y dolorida después de que se le hubiera quedado atrapada entre dos asientos de un tren.
Tras varias pruebas sin resultados concluyentes, una biopsia determinó que los síntomas nada tenían que ver con el accidente: la chica había desarrollado un sarcoma –un tipo de tumor agresivo–, y ni siquiera la amputación de parte del brazo consiguió evitar su muerte unos meses después. Obsesionado con el caso, Coley revisó la literatura médica en busca de algún procedimiento más eficaz. Lo que encontró se considera ahora como el punto de partida de la inmunoterapia.
Años antes, otro sarcoma de un paciente diagnosticado como incurable disminuyó hasta desaparecer tras haber sufrido una infección por una bacteria del género Streptococo. Coley pensó que su sistema inmunitario había reaccionado no solo contra la infección, sino también contra el cáncer y, para probarlo, infectó a uno de sus propios pacientes con el mismo tipo de bacteria. En pocas semanas este se recuperó.
Entusiasmado, Coley infectó durante los años siguientes a numerosos enfermos más, probando diferentes combinaciones. Aunque siguió cosechando éxitos, el procedimiento solo funcionaba a veces y no se sabía de qué dependía su éxito o su fracaso. Además, no parecía tan eficaz en otros tumores. La radioterapia y la quimioterapia, mucho más dóciles y susceptibles a un protocolo preestablecido, se impusieron como las armas a utilizar contra el cáncer.
Pero su idea nunca se abandonó por completo. En las últimas décadas se han probado diferentes formas de atacar el cáncer a través del sistema inmunitario: con anticuerpos específicos, citoquinas –moléculas liberadas durante la reacción de defensa– o vacunas terapéuticas contra el tumor. Sin embargo, salvo en el caso de determinados anticuerpos, se han logrado escasos resultados relevantes y solo existe una vacuna aprobada, con eficacia limitada, contra el cáncer de próstata.
Esto ha sido así hasta el año 2013, cuando los resultados de varios ensayos clínicos con un nuevo tipo de fármacos han devuelto a la inmunoterapia al escaparate, tanto que la revista estadounidense Science la ha escogido como el avance científico del año.
El mayor hito de la ciencia en 2013
“¿Nos arriesgamos escogiendo y promocionando unos trabajos cuyo impacto final todavía se desconoce? ¿Fuimos irresponsables al catalogar como gran avance una estrategia que únicamente se ha probado en unos pocos pacientes y que solo ha ayudado a algunos de ellos?”. Esta es la duda expuesta en el editorial que Science dedica a la inmunoterapia contra el cáncer. Y seguramente fue ese interrogante lo que hizo que su competencia, la publicación británica Nature, no la incluyera en su lista, aunque sí le dedicó un extenso monográfico en compensación.
“En última instancia, nuestra conclusión es que la inmunoterapia contra el cáncer aprueba el examen –afirman en Science–. Y lo hace porque este año diversos ensayos clínicos han consolidado su potencial y persuadido incluso a los escépticos”.
Los editores de la prestigiosa revista se refieren a los ensayos con los llamados ‘inhibidores de puntos de control inmunitarios’. Estos fármacos sacan al tumor del escondite donde consigue refugiarse del sistema de defensa.
El papel del sistema inmunitario frente a los tumores “ha sido un tema de mucha controversia durante los últimos 50 años, pero ahora está probado que tiene un papel de inmunovigilancia”, explica a Sinc Antoni Ribas, oncólogo de la Universidad de California en Los Ángeles y responsable de una de las últimas investigaciones que han relanzado la inmunoterapia.
No solo se ha probado que es más fácil provocar cáncer en ratones inmunodeficientes, sino que pacientes con inmunodepresión crónica –como los sometidos a tratamientos tras un trasplante de órgano– “tienen una incidencia más alta de cánceres inducidos por infecciones infecciones virales [como el virus del papiloma humano para el cáncer de cuello de útero] y agentes carcinógenos [como el tabaco para el de pulmón]”, dice el especialista.
En junio de 2013, durante la reunión anual de la Sociedad Estadounidense de Oncología Clínica (ASCO) celebrada en Chicago, Ribas y otro colega de profesión dieron a conocer dos trabajos que fueron inmediatamente publicados en la revista New England Journal of Medicine, la más importante a nivel clínico. Ambos son ensayos en fase 1, pequeños estudios iniciales que usan diferentes dosis para comprobar la seguridad de un fármaco, no para establecer su verdadera eficacia. Los dos se hicieron en pacientes con melanoma avanzado resistente a los tratamientos y con escasa esperanza de vida.
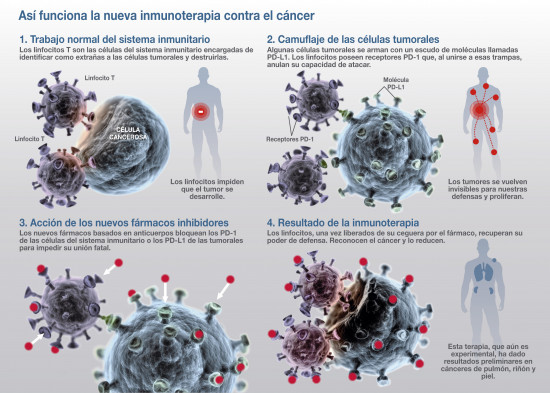
El estudio liderado por Ribas incluyó 135 pacientes que fueron tratados con lambrolizumab, un anticuerpo dirigido contra PD-1. Esta molécula es un talón de Aquiles de las defensas que nos protegen del cáncer, los linfocitos T, encargados de destruir a las células tumorales. Cuando la PD-1 de los linfocitos se une a su complementaria PD-L1, situada en la superficie de la célula cancerosa, se produce una cascada de reacciones que terminan inhabilitando a los linfocitos para ejercer su cometido. Las defensas se quedan ciegas ante el tumor, que se esconde así de su constante vigilancia.
Ahí es donde entra en acción el lambrolizumab. La misión del anticuerpo es impedir la unión nefasta, lo que permite a las defensas soltar su freno de seguridad, volver a reconocer al tumor como extraño y atacarlo. Es un cambio de paradigma. No se ataca directamente al cáncer, sino que se libera al ejército inmunitario para que luche con toda su artillería.
En total, un 38% de los pacientes así tratados respondieron significativamente al tratamiento, número que se elevó al 52% entre los que recibieron las dosis más altas. Y, aunque todavía no ha transcurrido suficiente tiempo para sacar conclusiones, Ribas explica a Sinc que, a la vista de los resultados, “se puede inducir una respuesta inmunitaria duradera, aunque seguramente haya que administrar un tratamiento a largo plazo para conseguirlo”.
Este efecto duradero es clave. Gran parte de la medicina personalizada se basa en terapias dirigidas que bloquean un aspecto particular de cada tumor, pero en muchos casos este se reproduce porque se adapta al tratamiento. De alguna manera, este tipo de inmunoterapia, que recluta un ejército mucho más versátil, capaz de reconocer numerosos enemigos, permite generar células con memoria, reeducadas para atacar al tumor.
El otro estudio fue liderado por Jedd Wolchok, del hospital Memorial Sloan Kettering en Nueva York –¿recuerdan a Coley?–. En este caso se trataron 53 pacientes con dos anticuerpos diferentes: el nivolumab, contra PD-1; y el ipilimumab, contra CTLA-4, otra molécula implicada en la inhibición del sistema inmunitario y cuyo uso para melanoma está aprobado desde 2011.
Los resultados fueron muy similares a los del trabajo anterior: un 40% de pacientes respondió al tratamiento, porcentaje que aumentó hasta el 53% cuando se empleaba la combinación de dosis que resultó ser más eficaz. Sin embargo, los efectos secundarios fueron notablemente mayores como consecuencia de reacciones autoinmunes. El sistema inmunitario ‘liberado’ atacaba tejidos del propio paciente.
Estos dos estudios son el espaldarazo en que se basa Science para justificar su elección. Pero la verdadera sorpresa tuvo lugar un año antes. Al fin y al cabo, el melanoma es un tipo de tumor muy particular. Si este tipo de inmunoterapia solo fuera eficaz para este cáncer de piel el avance sería importante, pero no revolucionario.
Ocurre, sin embargo, que otros dos ensayos de fase 1 publicados en 2012 usaron anticuerpos contra PD-1 o PD-L1 en pacientes con otros tipos de tumores avanzados. No se observaron mejoras en el caso de estómago o mama, por ejemplo, pero sí hubo un pequeño número de pacientes con cáncer de riñón y de pulmón que respondieron a la terapia.
Aunque preliminares, estos resultados suponen una auténtica piedra de toque y alientan el potencial de estos anticuerpos sobre un amplio abanico de tumores.
De hecho, para Ribas “solo el tiempo nos dirá qué tumores se muestran resistentes, pero ya sabemos que algunos como el de próstata o mama, donde hay menos mutaciones que en cánceres inducidos por carcinógenos, estos nuevos fármacos no funcionan como un agente único”, es decir, por sí solos, sin combinar con otras terapias. Más ambicioso se muestra al respecto Wolchok, para quien, en principio, “ningún tipo de tumor debería ser excluido de antemano”.
Un futuro brillante pero todavía incierto
Para José Baselga, director clínico del Memorial Sloan Kettering, y que no ha participado directamente en estos estudios, “se trata probablemente del mayor avance en los últimos años. Si a este tipo de tratamientos le añadimos la terapia celular con linfocitos T mediante receptores quiméricos [otro tipo de inmunoterapia aún en fases más iniciales, pero especialmente prometedora en tumores de la sangre, como leucemias y linfomas] esto cambiará la manera en que tratamos el cáncer y aumentará la supervivencia”.
Eso sí, “la evidencia hasta la fecha es solo en melanoma y en cánceres de pulmón y riñón. Para el resto de tumores, aunque hay estudios en marcha, es todavía muy temprano”, insiste a Sinc.
En la actualidad solo hay un fármaco aprobado (ipilimumab) y únicamente para su uso en melanoma. Pasará un tiempo hasta saber si llegarán al mercado nuevos tratamientos y para qué tipo de tumores. No solo eso: es preciso determinar con exactitud los posibles efectos secundarios, así como identificar marcadores para predecir qué pacientes se beneficiarán y quiénes no.
Uno de los marcadores candidatos es el propio PD-L1, pero, como explica Wolchok a Sinc, “su expresión es dinámica y puede variar con el tiempo”. De hecho, “todavía no se ha identificado ningún marcador que permita saber si un paciente se va a beneficiar o no”, añade.
Además, este tipo de inmunoterapia podría administrarse conjuntamente con las ya existentes o con otras en fase de estudio, incluida quimioterapia, radioterapia, terapias dirigidas o incluso vacunas, lo cual exigirá numerosos estudios adicionales.
Otro asunto será el de los costes, ya que “seguramente serán fármacos caros”, opina Ribas. Aunque también añade que, desde una perspectiva más amplia, “puede que salgan baratos, porque tratar de forma efectiva un cáncer metastásico y evitar los mayores gastos que supone un tratamiento en las fases terminales en una proporción significativa de pacientes será un ahorro”.
El editorial de Science acaba, como este artículo, así: “Incluso en el resbaladizo estado en que la oncología se encuentra, es bastante cierto que un libro se ha cerrado y otro nuevo se ha abierto. Cómo terminará nadie lo sabe”.