El estudio de los telómeros, las estructuras que protegen el extremos de los cromosomas, se ha convertido en un área candente de la biología. En los últimos años no solo se ha confirmado su relación con el envejecimiento; defectos en los telómeros aparecen asociados a cada vez más enfermedades, incluyendo numerosos tipos de cáncer.
La revisión que publican al respecto Paula Martínez y María Blasco, del Centro Nacional de Investigaciones Oncológicas (CNIO), en Trends in Biochemical Sciences, subraya la importancia de investigar estas estructuras para mejorar el diagnóstico y desarrollar posibles tratamiento de muchas enfermedades. Los telómeros, opinan estas investigadoras, tendrán una importancia cada vez mayor en la clínica.
Los cromosomas en cada una de nuestras células están hechos de ADN y tienen forma de hebra, con una especie de capuchón en los extremos. Sin esta caperuza final las hebras de ADN se enlazan químicamente a otras, es decir los cromosomas se fusionan, y eso resulta letal para la célula. Las estructuras que evitan la catástrofe son los telómeros.
Se descubrieron en los años treinta, pasaron décadas hasta que alguien decidió estudiarlos a fondo, y desde finales de los años noventa no han abandonado la primera fila de la biología. Los biólogos se sorprenden de su asombrosa e inesperada complejidad, y de su importancia para la salud.
“La biología de los telómeros es extremadamente compleja, y cuanto más se descubre más nos damos cuenta de lo que queda por descubrir”, afirma Paula Martínez, del grupo de Telómeros y Telomerasa del CNIO.
“Lo que más me sorprende es el número tan elevado de factores que, según estamos viendo, son esenciales para el mantenimiento del telómero, y sobre todo la coordinación tan precisa que se requiere entre todos ellos”.
Ya el hecho de que los telómeros se hayan conservado a lo largo y ancho del árbol evolutivo –en la mayoría de los eucariotas: vertebrados, plantas e incluso en seres unicelulares como las levaduras– indica su importancia. Además de para prevenir la fusión de los cromosomas, los telómeros son necesarios para evitar la pérdida de información genética cada vez que la célula se divide.
Evitar pérdida de información
Cuando la célula se replica, la maquinaria molecular que se ocupa de duplicar los cromosomas –para que cada célula hija tenga una copia– no puede llegar hasta el final. Es una imposibilidad fundamental, producto del modo mismo de funcionamiento de la maquinaria de copia del ADN, e implica que si al final del cromosoma hubiera material genético con información importante para la célula, se perdería.
Los telómeros impiden que eso suceda: consisten en una secuencia de ADN que no contiene ningún gen y que se repite numerosas veces –en humanos y otras especies la secuencia es TTAGGG; las letras corresponden a tres de los ladrillos que integran el ADN: timina, adenina y guanina–.
Así, el acortamiento del ADN con cada división no es importante. O no lo es, al menos, hasta que se llega a un cierto límite. Cuando los telómeros se vuelven demasiado cortos empiezan los problemas que se han asociado al envejecimiento: la célula interpreta los telómeros críticamente cortos como un daño irreparable y reacciona dejando de dividirse, lo que impide que los tejidos se regeneren.
Esto ocurre en las células sanas, pero no en las cancerígenas. Hay una enzima, la telomerasa, que es capaz de alargar los telómeros de nuevo, y que la mayoría de las células de un organismo adulto no tienen pero que sí está activa en las células tumorales. Al reparar los telómeros la telomerasa permite que las células tumorales sigan proliferando y sean por tanto virtualmente inmortales.
Esta relación con el envejecimiento y el cáncer hace que se estén estudiando intensamente estrategias basadas en los telómeros para combatir tanto el cáncer como las enfermedades asociadas a la edad. Recientemente el grupo de Blasco ha demostrado que es posible quitar la inmortalidad al cáncer actuando sobre los telómeros.
‘Zoom’ en el final del final
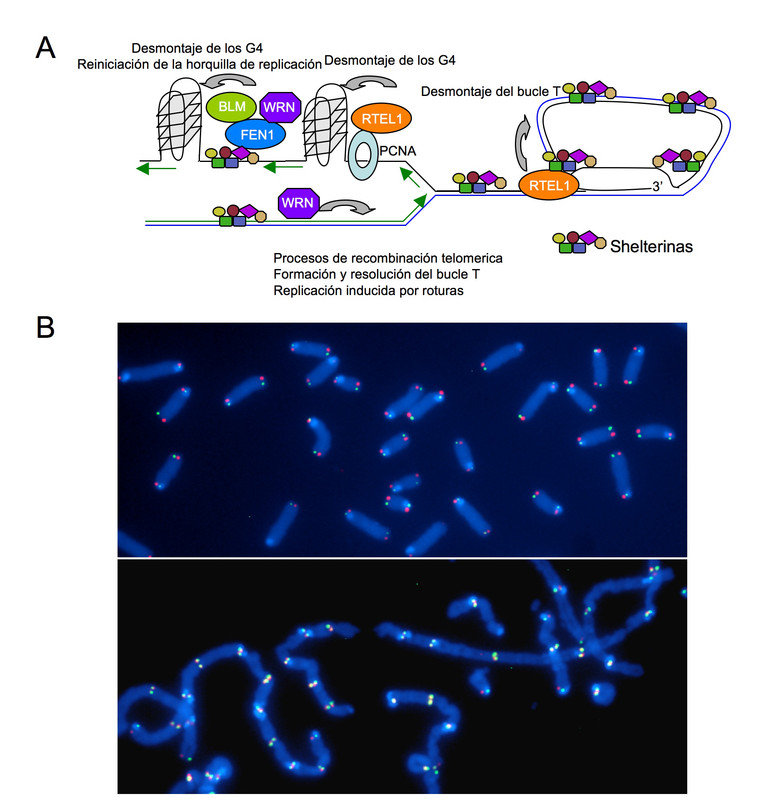
Sin embargo, la descripción anterior de los telómeros es una versión simplificada de la historia. Hoy se sabe que, envolviendo el ADN telomérico, hay una estructura protectora compuesta por seis proteínas llamadas shelterinas, que son cruciales. Otro de los descubrimientos más recientes es el de que hay proteínas que, aunque no están en los telómeros, interaccionan con ellos en momentos precisos para hacer posible su función.
Esas proteínas permiten, por ejemplo, que los telómeros se desenrollen. Porque otro hallazgo reciente es que la secuencia que se repite en los telómeros, TTAGGG, termina en una hilera de ADN de una única cadena que se curva formando un bucle y se anuda con la hilera original de doble cadena formando una triple cadena. “Sí, es muy complicado”, admite Martínez, “pueden formarse estructuras de hasta cuatro cadenas de ADN”.
Cuando la célula se divide también se replican los telómeros. Esto implica que antes debe desenrollarse su bucle final y después formarse de nuevo. Este proceso también contribuye al acortamiento telomérico, y en él –ahora se sabe– son claves algunas de las shelterinas, así como otras proteínas asociadas que interaccionan con el telómero.
Síndromes teloméricos
Para Martínez, “cada vez se encuentra más relación entre mantenimiento de los telómeros y diversas enfermedades”.
Se han identificado síndromes teloméricos, o telomeropatías, en pacientes con mutaciones en la enzima telomerasa. En este grupo se incluye por ejemplo la fibrosis pulmonar, y problemas relacionados con el mal funcionamiento de la médula ósea. Igualmente se ha hallado una relación directa entre disfunciones en los telómeros y numerosos tipos de cáncer.
Más recientemente se ha descubierto además que también las mutaciones en las proteínas que protegen el ADN telomérico, las shelterinas, y las que interaccionan con los telómeros, se asocian a diversas enfermedades, como la disqueratosis congénita, el síndrome de Hoyeraal– Hreidarsson o el síndrome de Revesz.
“Estos hallazgos subrayan la plétora de componentes y rutas que controlan las funciones teloméricas”, escriben las autoras en el trabajo. “En el futuro la investigación podría sacar a la luz más factores aún desconocidos que podrían ampliar nuestra comprensión de los mecanismos del cáncer, y de los síndromes asociados al acortamiento de los telómeros. Este conocimiento, esperamos, se trasladará a la clínica para la mejora del diagnóstico y el tratamiento de enfermedades”.
El grupo de Blasco está financiado por el Ministerio de Economía y Competitividad, la Unión Europea y la Fundación Botín y Banco Santander, a través de Santander Universidades, entre otros.
(CNIO)