Un presenta un modelo innovador que mejorará los tratamientos de fertilidad in vitro y podrá servir, si se desarrolla comercialmente, como método contraceptivo no hormonal.
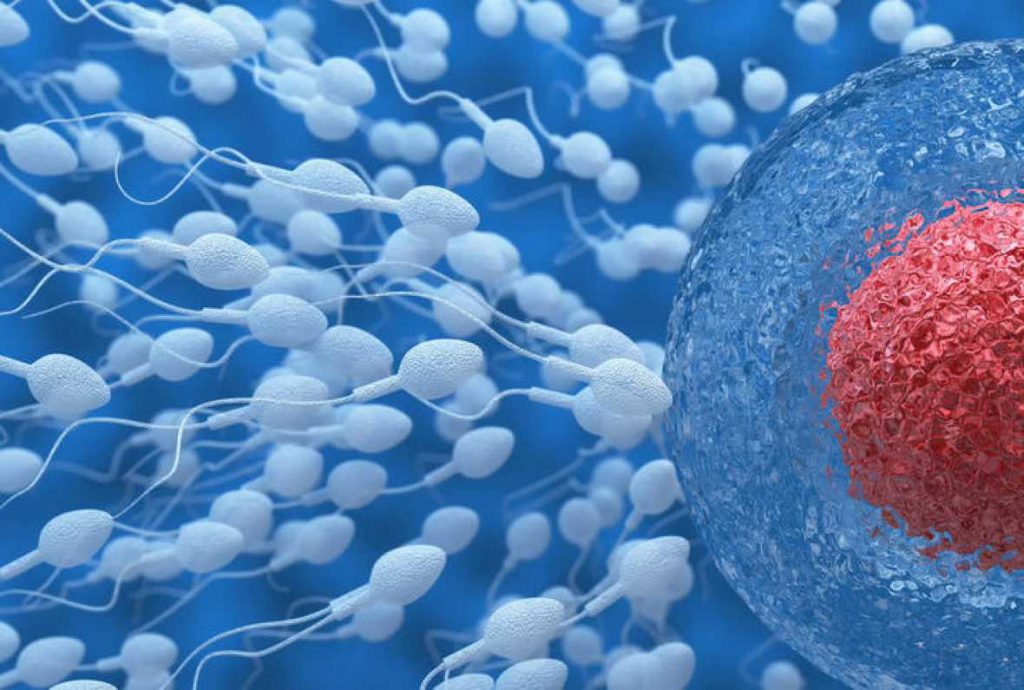
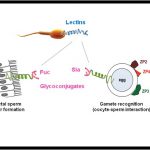
Para que un espermatozoide se una a un óvulo y lo fecunde tiene que reconocer específicamente la matriz que le rodea, conocida como zona pelúcida (ZP). “Aunque la estructura de la zona pelúcida no es del todo conocida, sabemos que está formada por cuatro proteínas en el caso de la especie humana y tres en ratones, señala la investigadora del Departamento de Biología Celular e Histología de la Universidad de Murcia (UMU) María Jiménez-Movilla, participante en el estudio
Un trocito de una proteína de la matriz que rodea el óvulo permite que el espermatozoide reconozca al óvulo para fecundarlo
Distintos laboratorios mundiales han tratado de descifrar cuál de estas proteínas estaba implicada en la fecundación entre óvulo y espermatozoide, pero fue recientemente, en el laboratorio de Jurrien Dean (Instituto Nacional de Salud de EE UU), director de este trabajo, donde se determinó que era específicamente un trocito de la proteína ZP2 de la matriz que rodea el óvulo (tanto en humano como en ratón) la que permite que el espermatozoide reconozca al óvulo para fecundarlo.
Para el desarrollo del estudio, publicado en Science Translational Medicine, se introdujeron en el útero de una ratona unas esferas (rebozadas por trocitos de ZP2 de ratón) que reproducen la forma tridimensional del óvulo. “Las esferas con la proteína ZP2 atraen a los espermatozoides evitando que continúen su trayectoria hasta el óvulo, de esta manera, se impide que las ratonas se fecunden tras varios cruces y durante varias semanas y, sin embargo, con el paso del tiempo y una vez retiradas las esferas del útero, las ratonas recuperan su fertilidad, por lo que es un proceso reversible”, apunta la investigadora de la UMU.
Por otro lado, en el caso de los humanos, según Jiménez-Movilla, se usó la misma estrategia pero con las esferas rebozadas por trocitos de proteína ZP2 humana, a partir de la que se ha desarrollado un modelo para identificar aquellos espermatozoides ‘superiores’ o con mayor capacidad fecundante.
Espermatozoides de varios donantes se incubaron con las esferas para posteriormente recuperar aquellos que se habían unido a ellas. La población de espermatozoides que había sido seleccionada presentó mayor capacidad para unirse al óvulo, describiendo de esta manera un método para la selección espermática.
‘Superespermatozoides’
“Los métodos de selección espermática empleados habitualmente en las técnicas de fecundación in vitro se basan en la morfología y motilidad del espermatozoide, sin embargo, con este método conseguimos muestras enriquecidas con ‘superespermatozoides’ con las que mejorar las técnicas de fecundación in vitro, sobre todo en los casos de problemas de fertilidad debido al componente masculino”, explica la investigadora de la UMU.
Por tanto, los avances alcanzados por los investigadores podrían ayudar a resolver problemas como la deficiencia en la calidad espermática, ya que será posible enriquecer la muestra para conseguir solamente los mejores espermatozoides. “La ratio de éxito de la fecundación in vitro es todavía muy baja y con este método aumentará la posibilidad de fertilización”, indica.
El muevo método mejora los tratamientos de fertilidad 'in vitro' y a la vez podrá servir como contraceptivo no hormonal
La investigadora ha caracterizado la unión del espermatozoide con las esferas creadas en el laboratorio. Para ello, ha hecho uso de los servicios de microscopía electrónica y análisis de la UMU. “He observado con microscopía electrónica cómo se encuentra el espermatozoide cuando está unido a la esfera y preparado para fecundar, es decir, su morfología”, añade Jiménez-Movilla.
Según la investigadora, el desarrollo tecnológico de los modelos aplicados e innovadores que presentan en este trabajo, a partir de la descripción molecular de la proteína ZP2 del óvulo responsable del reconocimiento con el espermatozoide para poder fecundarlo, permitirá el impulso industrial de dichos modelos y su aplicación en el campo de la reproducción.
Además, estos hallazgos están permitiendo trasladar la experiencia a otras especies como los animales de granja, donde se aplicará esta tecnología tanto para la selección espermática y mejora de producción, como en métodos para el control reproductivo de algunas especies sin necesidad del uso de fármacos hormonales que puedan alterar su fisiología.
Este trabajo, realizado con el apoyo del Instituto Murciano de Investigación Biosanitaria (IMIB) de la Comunidad Autónoma de la Región de Murcia y la Universidad de Murcia, está subvencionado por el programa Jóvenes líderes en investigación de la Fundación Séneca, Agencia de Ciencia y Tecnología de la Región de Murcia.
Referencia bibliográfica:
Avella, Matteo A., Baibakov, Boris A., Jimenez-Movilla, Maria, Burkart Sadusky, Anna & Dean, Jurrien. 2016 – ZP2 peptide beads select human sperm in vitro, decoy mouse sperm in vivo, and provide reversible contraception. Science Translational Medicine 8(336): 336ra60. DOI: 10.1126/scitranslmed.aad9946