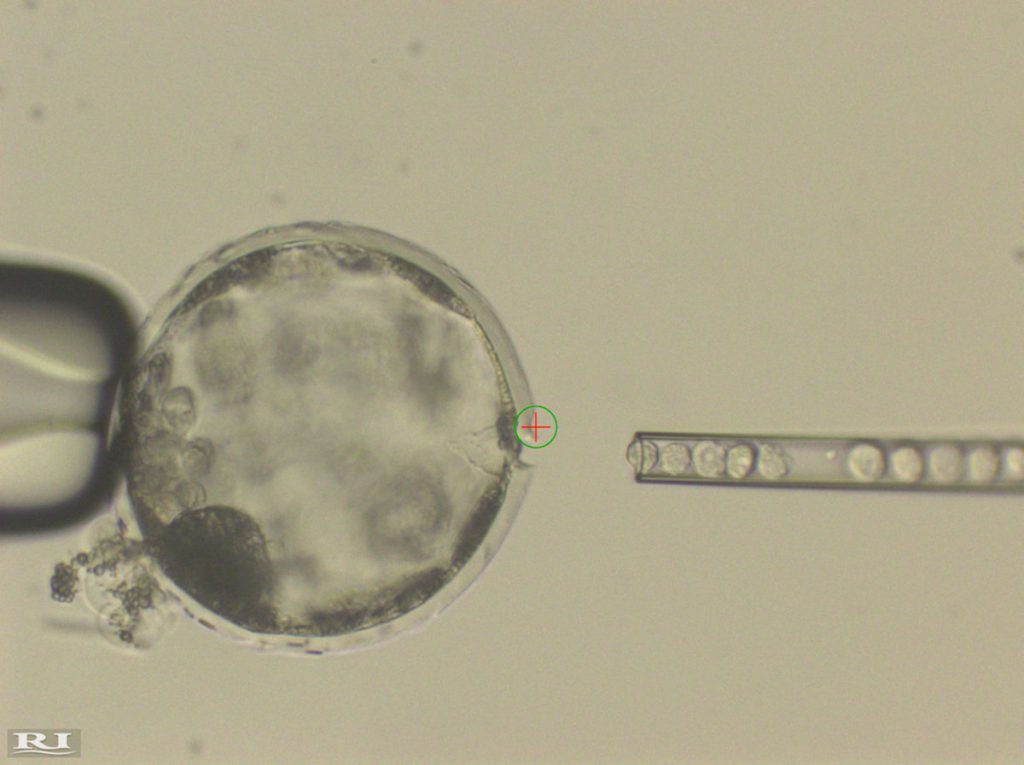
La incubación de órganos humanos en animales para su uso en trasplantes y medicina regenerativa ha dado un nuevo paso, según los resultados de un estudio publicado esta semana en la revista Cell que cuenta con participación española.
Investigadores del Instituto Salk de Estudios Biológicos (EE UU), entre los que se encuentra el español Juan Carlos Izpisua Belmonte, han logrado incubar con éxito los primeros embriones con células madre de humanos y cerdos.
El objetivo de este trabajo es desarrollar tejidos orgánicos y órganos funcionales que puedan usarse en trasplantes
“La meta es desarrollar tejidos orgánicos y órganos funcionales que puedan usarse en trasplantes, aunque aún estamos muy lejos de conseguirlo. Pero es un primer paso muy importante”, explica Izpisua.
Uno de los principales problemas durante décadas de trabajo ha sido conseguir que las células madre creadas en placas de Petri se convirtieran en órganos funcionales.
Izpisua lo compara con duplicar una llave, “pueden parecer idénticas, pero al llegar a casa, la copia no abre. Algo estábamos haciendo mal”. Para los investigadores, el cambio de enfoque e incubar estos órganos en animales resultó ser una idea mucho más fructífera.
Animales quiméricos
Los primeros experimentos se llevaron cabo con ratones, inyectando células madre de rata en embriones de ratón y dejándolos madurar. Mediante herramientas de edición de genoma, como CRISPR, se ha trabajado con embriones fertilizados.
En esos embriones se eliminaron genes involucrados en el crecimiento de órganos como los ojos, el corazón o el páncreas y se rellenaron esos huecos con su equivalente en genes de rata. El resultado fue un animal quimérico, un ratón híbrido con ojos, corazón y páncreas de rata.
El estudio ha involucrado a más de 40 personas durante cuatro años; en él se han usado unos 1.500 embriones
El siguiente paso fue integrar genes humanos en embriones animales. Aunque en un primer momento se barajó el uso de vacas y cerdos debido a su tamaño, finalmente el equipo se centró en el ganado porcino por su potencial económico.
Aún así, el esfuerzo ha sido considerable, un tour de force, como lo define Izpisua. El estudio ha involucrado a más de 40 personas durante más de cuatro años, y en él se han usado unos 1.500 embriones.
Otra de las dificultades fue la velocidad en el periodo de gestación de los cerdos, un tercio más lento en comparación con los humanos. Los científicos tenían que inyectar las células humanas en el momento justo para coincidir con el estado de desarrollo equivalente en el animal.
Izpisua lo define así: “Es como si las células humanas entrasen en una autopista a mayor velocidad que la permitida. Así es más fácil que se produzcan accidentes”.
Problemas éticos
Se usaron distintos tipos de células humanas para comprobar cual tenía una mayor tasa de supervivencia. Las que mostraron mayores posibilidades para su desarrollo y mayor supervivencia fueron las llamadas células pluripotentes.
Las células supervivientes formaron un embrión quimérico entre humano y cerdo que se implantó en cerdas y así estudiar su desarrollo durante tres o cuatro semanas, tiempo suficiente para evitar problemas éticos y entender cómo se mezclan las células de cerdo y humanas.
Los resultados iniciales muestran que el nivel de contribución de las células humanas a estos embriones quiméricos no era demasiado alto, algo que los científicos consideran buenas noticias, precisamente por la preocupación ética que supone crear quimeras «demasiado humanas».
“Primero queríamos saber si las células humanas contribuyen lo suficiente como para decidir si continuar con la investigación. Ahora que sabemos que podemos hacerlo, el siguiente paso será mejorar la eficiencia de esas células madre para formar órganos concretos en cerdos”, concluye Izpisua.
La investigación sigue su curso en esa línea. Para ello usarán el mismo método de ´corta-pega genético´ usando CRISPR que se utilizó con los ratones, editando el genoma del cerdo y llenando los huecos con células humanas.
Referencia bibliográfica:
Jun Wu, et al. «Interspecies Chimerism with Mammalian Pluripotent Stem Cells”. Cell, 2017 DOI: http://dx.doi.org/10.1016/j.cell.2016.12.036